SAN DIEGO - Un equipo de investigación de UC San Diego ha descubierto cómo una molécula en el exterior de la proteína de espiga SARS-Cov-2 actúa como una "puerta" para el virus que causa la infección del COVID-19, lo que podría ayudar a encontrar una manera de contrarrestar el virus; todo lo que se necesita es una "clave" para bloquearlo, explica un nuevo estudio.
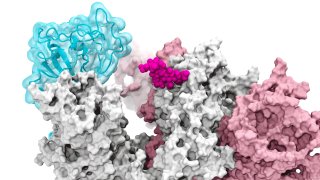
La investigación publicada el jueves en la revista "Nature Chemistry", describió cómo los glicanos – moléculas que forman un residuo azucarado alrededor de los bordes de la proteína de espiga – pueden permitir que el virus entre e infecte las células humanas sanas.
Recibe las noticias locales y los pronósticos del tiempo directo a tu email. Inscríbete para recibir newsletters de Telemundo San Diego aquí.
"Básicamente descubrimos cómo la espiga se abre e infecta", dijo Rommie Amaro, química biofísica computacional de la UCSD, quien ayudó a desarrollar una visualización detallada de la proteína de espiga SARS-CoV-2 que se adhiere eficientemente a nuestros receptores celulares.
"Hemos descubierto un secreto importante del pico en cómo infecta las células. Sin esta puerta, el virus se vuelve básicamente incapaz de infección", dijo Amaro, profesor de química y bioquímica y autora principal del nuevo estudio.
Amaro dijo que cree que el descubrimiento de la "puerta" por parte del equipo de investigación abre vías potenciales para nuevas terapias para contrarrestar la infección por SARS-CoV-2. Si las "puertas" del glicano pueden ser farmacológicamente "bloqueadas" en la posición cerrada, entonces se previene efectivamente la apertura de entrada y por tanto la infección.
Otros participantes en el proyecto incluyen a la coautora Lillian Chong en la Universidad de Pittsburgh, a la primera autora y estudiante de posgrado de la UCSD Terra Sztain y el coautor y becario postdoctoral de la UCSD Surl-Hee Ahn.
La capa de glicanos de la espiga ayuda a engañar al sistema inmune humano, ya que se presenta como un residuo azucarado, según la investigación. Las tecnologías anteriores s representaban los glicanos en posiciones estáticas, abiertas o cerradas, lo que inicialmente no atrajo mucho el interés de los científicos. Las simulaciones de supercomputación permitieron a los investigadores desarrollar "películas" dinámicas, que revelaron las puertas de los glicanos activándose de una posición a otra, ofreciendo una pieza sin precedentes en la historia de la infección.

"Pudimos ver la apertura y el cierre", dijo Amaro. "Esa es una de las cosas realmente geniales que estas simulaciones te dan – la capacidad de ver estas películas muy detalladas.
Local
"Cuando los miras, te das cuenta de que estás viendo algo que de otra manera habríamos ignorado", continuó. "Miras sólo la estructura cerrada, y luego miras la estructura abierta, y no parece nada especial. Es sólo porque capturamos la película de todo el proceso que realmente lo ves haciendo lo suyo."
Las simulaciones se realizaron por primera vez en "Comet" en el Centro de Supercomputadoras de San Diego en UCSD y más tarde en "Longhorn" en la Universidad de Texas, Austin. Tal poder de computación proporcionó a los investigadores unas vistas a nivel atómico del dominio de la unión del receptor de proteína de espiga, o RBD, desde más de 300 perspectivas. Las investigaciones revelaron al glicano "N343" como el eje que empuja el RBD y que cambia la posición de "abajo" a "arriba" para permitir el acceso a los receptores de la célula huésped. Los investigadores describen la activación del glicano como una similar a un mecanismo de "palanca molecular".



